L’obiettivo del Regolamento UE 745/2017 (MDR) sui dispositivi medici è quello di tutelare la sicurezza del paziente anche rendendo tracciabili i dispositivi medici immessi sul mercato.
È proprio in questo contesto che si inserisce la nuova incombenza che interessa gli studi odontoiatrici relativa alla registrazione del Codice Unico di Identificazione (UDI), divenuta obbligatoria dal 15 gennaio 2024.
L’obbligo della tracciabilità permette a ogni anello della catena distributiva di poter risalire in modo preciso ai fornitori e produttori dei materiali con cui i dispositivi sono stati realizzati, in modo preciso e puntuale. Il fabbricate ha quindi il dovere di definire e mantenere aggiornata una procedura per applicare tempestivamente le opportune misure correttive eventualmente necessarie in caso di problematiche, fino al ritiro dal mercato di singoli lotti o di tutti i dispositivi oggetto della misura immessi in commercio. L’obbligo della tracciabilità vale anche per l’eventuale distributore del dispositivo medico che deve garantire la corretta identificazione della struttura sanitaria o l’operatore sanitario a cui il dispositivo è stato fornito.
È dunque molto importante assicurarsi di rifornirsi da partner distributivi in regola con il Regolamento MDR su questo aspetto (come ad esempio De Ore che è completamente strutturata per gestire questa procedura).
Proprio per questo motivo il Regolamento ha istituito un sistema globale di tracciabilità per i dispositivi (per tutta la filiera) basato sull’utilizzo di un codice unico riconosciuto a livello internazionale (il codice UDI, appunto) che contiene informazioni sul prodotto e sui soggetti che lo gestiscono.
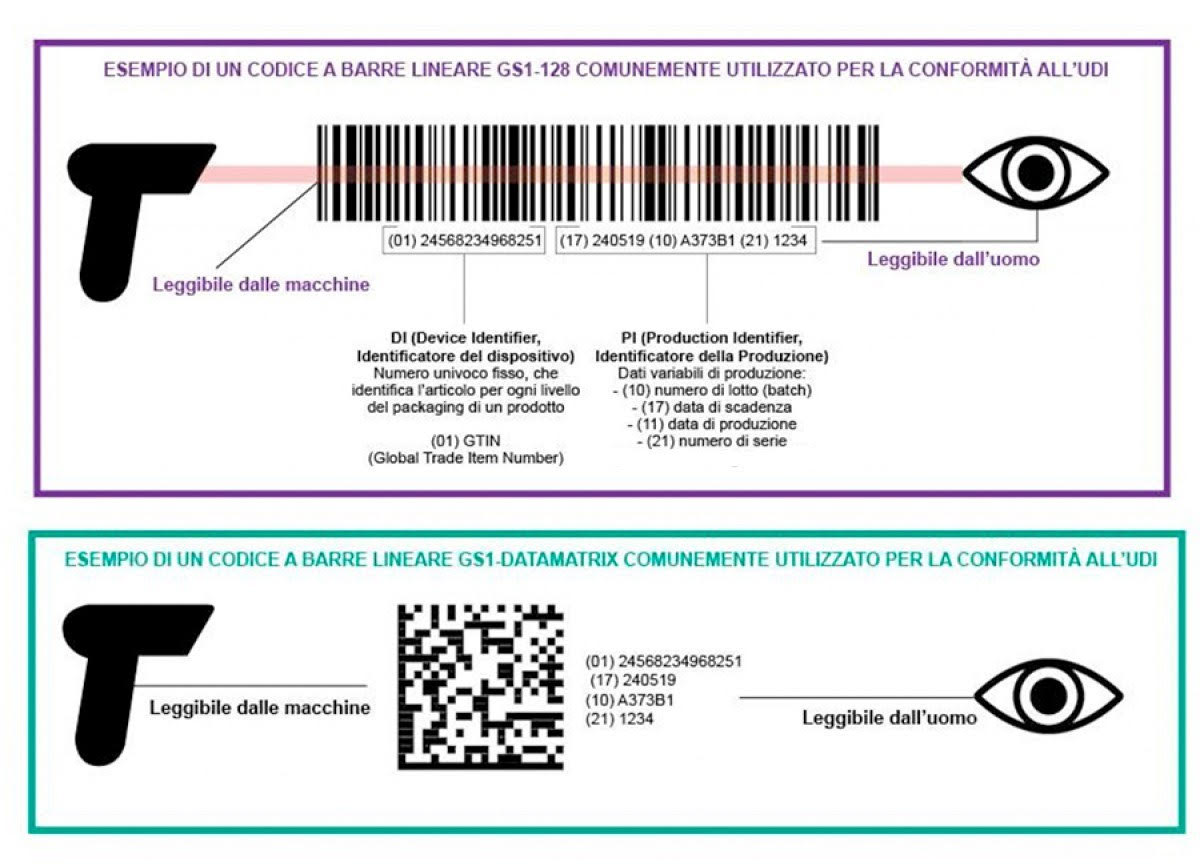
Il codice UDI, indicato dal fabbricante, è composto in particolare da una parte identificativa del dispositivo medico – UDI-DI (il codice del prodotto) – ed una parte identificativa della produzione – UDI-PI (ad esempio il numero di lotto). Da Regolamento il codice UDI deve essere espresso in formato leggibile sia dalle macchine (codice a barre o QR code) sia dall’uomo (numeri e lettere).
Nel dettaglio l’UDI può contenere queste informazioni, quando pertinenti alla natura del dispositivo medico:
- DI
- (01): Numero di identificazione globale del prodotto
- PI:
- (10) – numero di lotto
- (11) – data di produzione
- (17) – data di scadenza
- (21) – numero seriale
Ovviamente non sempre sono tutte presenti contemporaneamente (ad es. il serial number del dispositivo medico non è applicabile ad un prodotto consumabile, come un impianto dentale).
Per quanto concerne il ruolo degli Operatori Sanitari (come gli odontoiatri), in presenza di dispositivi medici di classe II o classe III, questi professionisti sono tenuti a registrare e conservare i relativi codici UDI, presenti e visibili nel packaging del dispositivo medico in modo da garantirne la tracciabilità.
Per concludere, possiamo dire che la responsabilità dell’odontoiatra è quindi legata alla registrazione delle informazioni del dispositivo medico (UDI) oltre certamente a quella nei conforti del paziente di utilizzare prodotti, certificati, rintracciabili, ovviamente sicuri e che rispettino la Direttiva.
Tuttavia, si precisa che in questa fase transitoria (dove alcuni dispositivi medici acquistati, nonostante siano tra quelli su cui il fabbricante deve indicare il codice, non lo abbiano ancora), il dentista dovrà continuare ad applicare il sistema di tracciabilità usato in precedenza. Per esempio, nel caso di impianto dentale, si può continuare a registrare il numero di lotto e la marcatura CE in cartella clinica (o in altri sistemi elettronici utilizzati) e sul passaporto implantare che verrà consegnato al paziente al termine della cura.
Per approfondire clicca qui e scarica il parere congiunto di ANDI, CAO, UNIDI

 Al 3° GBR GTR Symposium di fine Novembre a Bologna sono stati presentati 28 poster con i quali tanti clinici hanno condiviso la loro esperienza e le loro ricerche con i colleghi. Il dr Stefano Scavia di Milano ha partecipato con 2 lavori per illustrare un’innovativa tecnica di rilascio dei lembi chiamata GBR Pocket technique e l’abbiamo intervistato in merito. Il dr Stefano Scavia è un motivato e capace chirurgo classe 1977, socio fondatore della Minimal Invasive Dental Academy (M.I.D.A.), è innamorato della sua professione e non si fa sconti sui risultati.
Al 3° GBR GTR Symposium di fine Novembre a Bologna sono stati presentati 28 poster con i quali tanti clinici hanno condiviso la loro esperienza e le loro ricerche con i colleghi. Il dr Stefano Scavia di Milano ha partecipato con 2 lavori per illustrare un’innovativa tecnica di rilascio dei lembi chiamata GBR Pocket technique e l’abbiamo intervistato in merito. Il dr Stefano Scavia è un motivato e capace chirurgo classe 1977, socio fondatore della Minimal Invasive Dental Academy (M.I.D.A.), è innamorato della sua professione e non si fa sconti sui risultati. R – La Minimal Invasive Dental Academy è un progetto didattico nato nell’ultimo anno che si occupa di studiare, promuovere ed insegnare nuove tecniche minimamente invasive.
R – La Minimal Invasive Dental Academy è un progetto didattico nato nell’ultimo anno che si occupa di studiare, promuovere ed insegnare nuove tecniche minimamente invasive.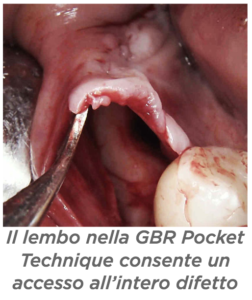 D – Dr Scavia, ci ha colpito molto il poster che ha presentato al 3° GBR GTR Symposium sulla Pocket Technique in GBR. Ce la descrive?
D – Dr Scavia, ci ha colpito molto il poster che ha presentato al 3° GBR GTR Symposium sulla Pocket Technique in GBR. Ce la descrive?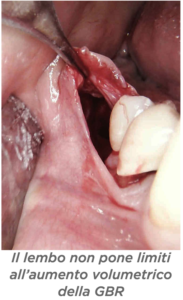 D – Quali sono i vantaggi?
D – Quali sono i vantaggi?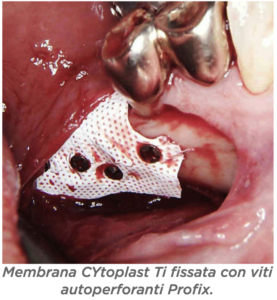 D – In quanti casi ha eseguito questa tecnica e in quanti ha avuto esposizioni?
D – In quanti casi ha eseguito questa tecnica e in quanti ha avuto esposizioni?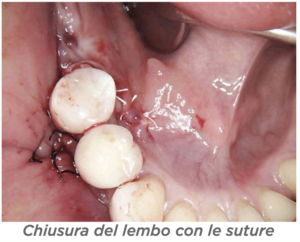 D – Ci sono indicazioni per non usarla?
D – Ci sono indicazioni per non usarla? Il dr Istvan Urban di Budapest è uno dei principali maestri mondiali delle tecniche di Guided Bone Regeneration. Recentemente ha presentato un nuovo device ibrido, una combinazione di membrana e mesh. L’abbiamo incontrato al 3°GBR GTR Symposium a Bologna dove ha tenuto un’intesa presentazione ad un folto pubblico di clinici.
Il dr Istvan Urban di Budapest è uno dei principali maestri mondiali delle tecniche di Guided Bone Regeneration. Recentemente ha presentato un nuovo device ibrido, una combinazione di membrana e mesh. L’abbiamo incontrato al 3°GBR GTR Symposium a Bologna dove ha tenuto un’intesa presentazione ad un folto pubblico di clinici.
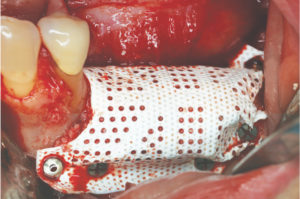 R – Questa è una bella domanda! Io associo la RPM a una membrana in collagene, ma in uno studio pre-clinico che è stato condotto non si è arrivati a nessuna conclusione in merito. Abbiamo visto un leggero vantaggio in caso di copertura con una membrana ma in ambiente pre-clinico il risultato è stato molto buono anche senza membrana riassorbibile. Comunque clinicamente siamo soliti associare una membrana in collagene a copertura della RPM.
R – Questa è una bella domanda! Io associo la RPM a una membrana in collagene, ma in uno studio pre-clinico che è stato condotto non si è arrivati a nessuna conclusione in merito. Abbiamo visto un leggero vantaggio in caso di copertura con una membrana ma in ambiente pre-clinico il risultato è stato molto buono anche senza membrana riassorbibile. Comunque clinicamente siamo soliti associare una membrana in collagene a copertura della RPM.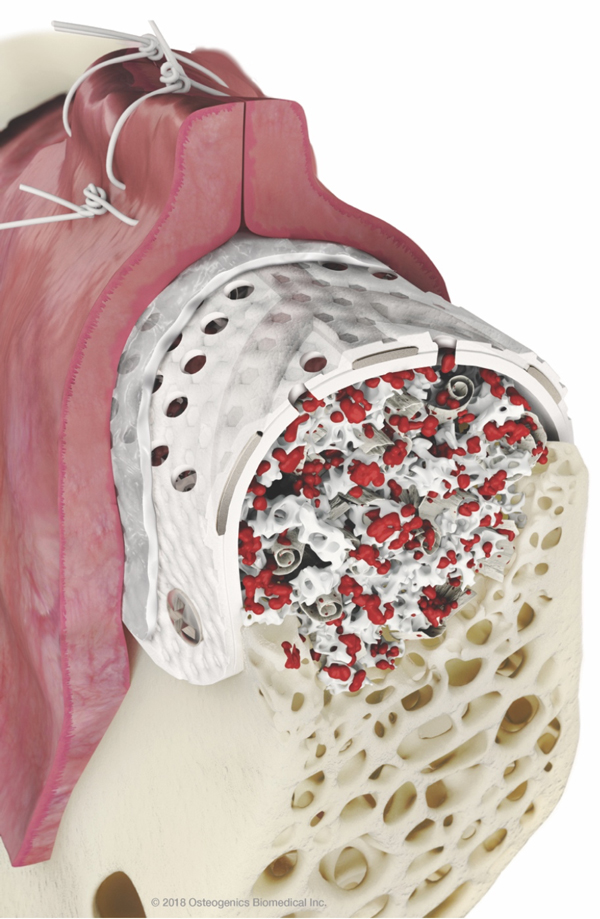 R – Con RPM notiamo una formazione ossea più veloce e pertanto per il posizionamento implantare non si deve attende oltre la rimozione della RPM nel 90% dei casi. Con una barriera non perforata la rimozione anticipata rispetto al posizionamento implantare è più logica; diversamente se ci sono dei fori i vasi possono crescere e non c’è necessità di aspettare. In una piccola percentuale dei casi, quando siamo in presenza di un difetto estremo, prima rimuoviamo la RPM e poi aspettiamo un paio di mesi per posizionare gli impianti.
R – Con RPM notiamo una formazione ossea più veloce e pertanto per il posizionamento implantare non si deve attende oltre la rimozione della RPM nel 90% dei casi. Con una barriera non perforata la rimozione anticipata rispetto al posizionamento implantare è più logica; diversamente se ci sono dei fori i vasi possono crescere e non c’è necessità di aspettare. In una piccola percentuale dei casi, quando siamo in presenza di un difetto estremo, prima rimuoviamo la RPM e poi aspettiamo un paio di mesi per posizionare gli impianti.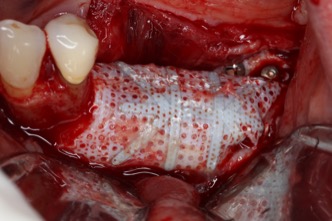
 D – Cosa accade nel caso di esposizione delle Reinforced Perforated Mesh – RPM?
D – Cosa accade nel caso di esposizione delle Reinforced Perforated Mesh – RPM? R – Inizialmente il produttore Osteogenics Biomedical aveva sviluppato una prima versione della RPM che non è mai stata commercializzata. Si trattava di una mesh in PTFE forata su tutta la superficie ed era difficile da rimuovere. Diversamente dalla prima versione il device oggi commercialmente disponibile è un ibrido, una combinazione di una mesh e di una membrana.
R – Inizialmente il produttore Osteogenics Biomedical aveva sviluppato una prima versione della RPM che non è mai stata commercializzata. Si trattava di una mesh in PTFE forata su tutta la superficie ed era difficile da rimuovere. Diversamente dalla prima versione il device oggi commercialmente disponibile è un ibrido, una combinazione di una mesh e di una membrana. D – Un’ultima domanda: dove suggerirebbe l’impiego di una membrana tradizionale Cytoplast© in PTFE ad alta densità?
D – Un’ultima domanda: dove suggerirebbe l’impiego di una membrana tradizionale Cytoplast© in PTFE ad alta densità?

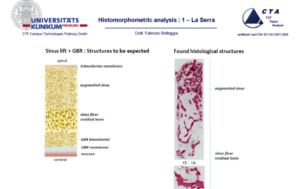 D – Hai quindi voluto una verifica istomorfometrica?
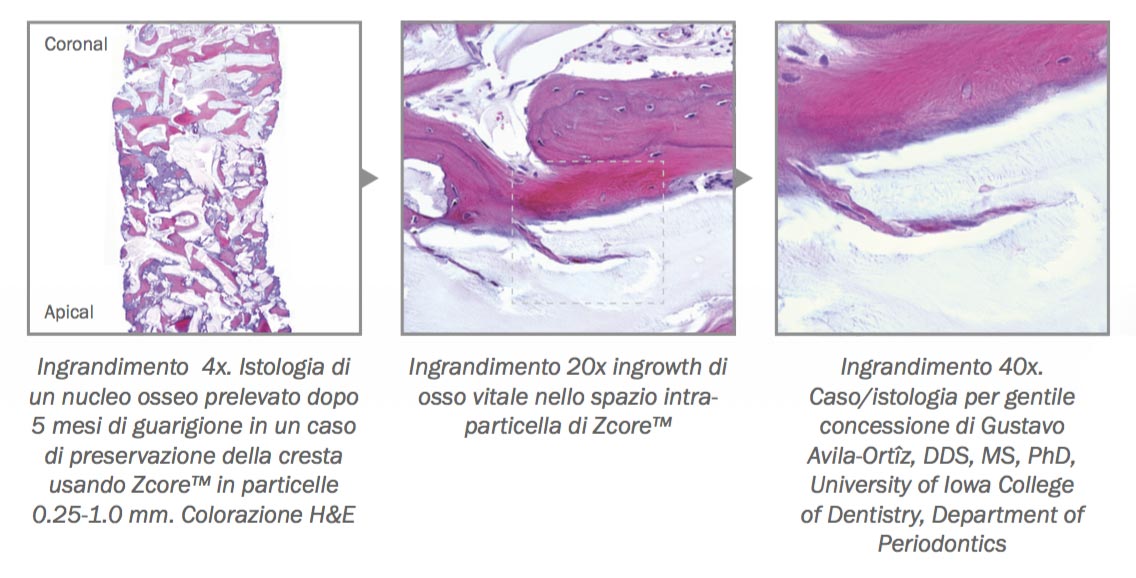
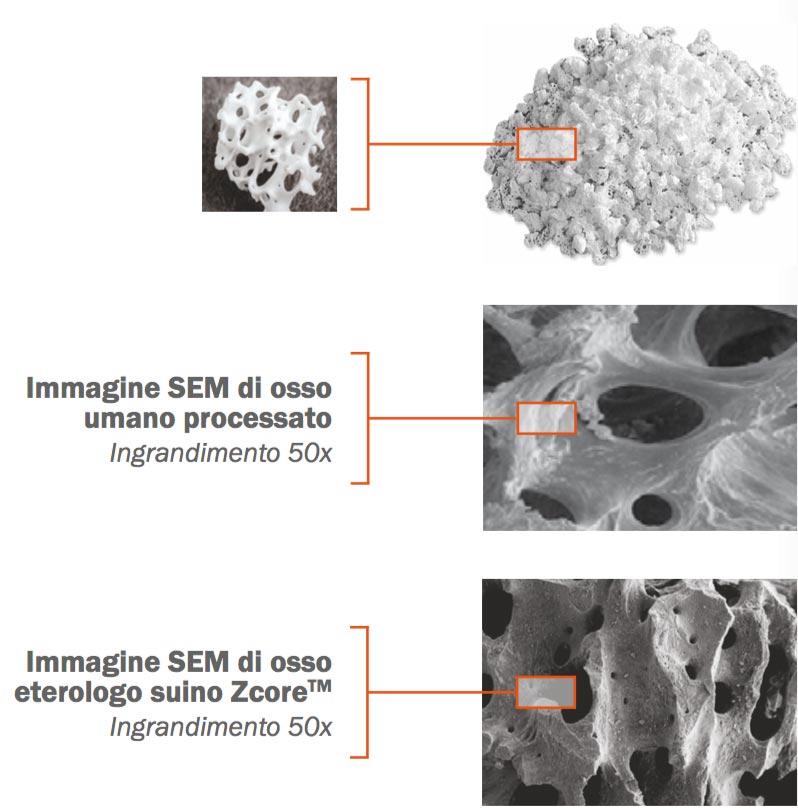
D – Hai quindi voluto una verifica istomorfometrica?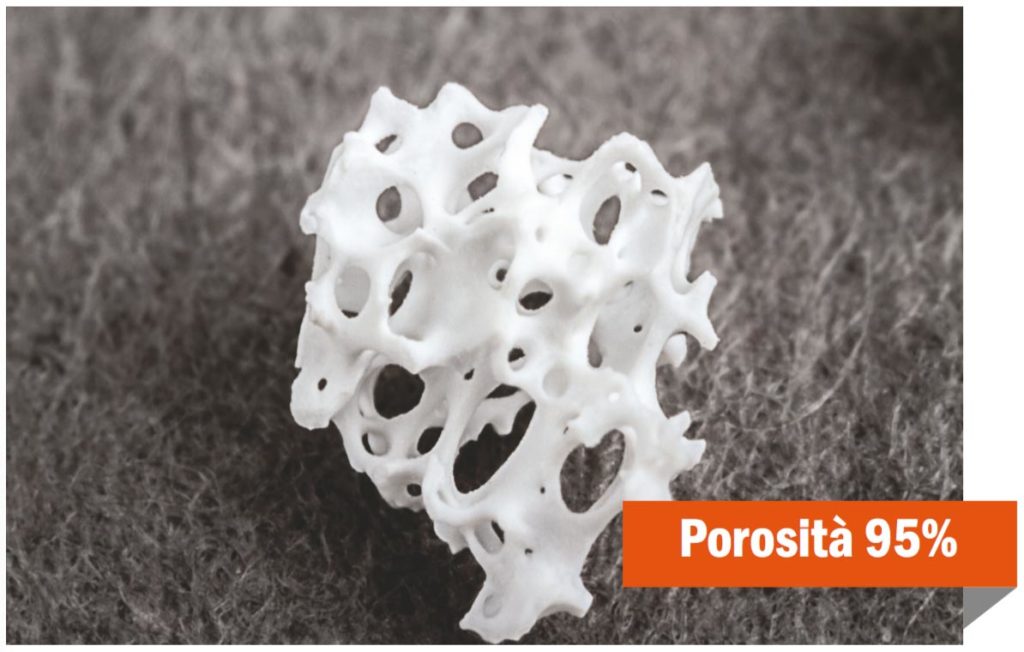




 Andrea Pilloni: cattedra di Parodontologia alla Sapienza a Roma, socio attivo SIdP, master in Periodontology a UCLA con una tesi sull’acido ialuronico (HA). Nessuno meglio di lui può esprimere un parere sull’impiego dell’HA in parodontologia e implantologia. L’abbiamo raggiunto via skype nel suo studio all’Università.
Andrea Pilloni: cattedra di Parodontologia alla Sapienza a Roma, socio attivo SIdP, master in Periodontology a UCLA con una tesi sull’acido ialuronico (HA). Nessuno meglio di lui può esprimere un parere sull’impiego dell’HA in parodontologia e implantologia. L’abbiamo raggiunto via skype nel suo studio all’Università. R – Devo ringraziare l’Università della California Los Angeles per aver accettato la mia proposta di ricerca sull’HA. Con il Prof. Bernard, Chairman del Bone Biology Center, iniziammo ad osservare il comportamento delle cellule mesenchimali di derivazione dalla calvaria che andavano in confluenza e si differenziavano in osteoblasti con qualità e tempistica decisamente migliori rispetto ai controlli quando erano associate all’HA. Subito dopo dimostrammo non solo l’attività batteriostatica dell’HA, ma anche di promozione della calcificazione del legamento. E così via via riuscimmo a confermare l’importante ruolo biologico della molecola dell’HA che è presente nell’early healing di quasi tutti i tessuti. Per fare un esempio, i tessuti embrionali e fetali sono ricchissimi di HA, mentre nell’adulto lo si ritrova in quantità davvero esigue. In quest’ultimo l’HA è presente in alte concentrazioni solo nel legamento parodontale e nell’umor vitreo.
R – Devo ringraziare l’Università della California Los Angeles per aver accettato la mia proposta di ricerca sull’HA. Con il Prof. Bernard, Chairman del Bone Biology Center, iniziammo ad osservare il comportamento delle cellule mesenchimali di derivazione dalla calvaria che andavano in confluenza e si differenziavano in osteoblasti con qualità e tempistica decisamente migliori rispetto ai controlli quando erano associate all’HA. Subito dopo dimostrammo non solo l’attività batteriostatica dell’HA, ma anche di promozione della calcificazione del legamento. E così via via riuscimmo a confermare l’importante ruolo biologico della molecola dell’HA che è presente nell’early healing di quasi tutti i tessuti. Per fare un esempio, i tessuti embrionali e fetali sono ricchissimi di HA, mentre nell’adulto lo si ritrova in quantità davvero esigue. In quest’ultimo l’HA è presente in alte concentrazioni solo nel legamento parodontale e nell’umor vitreo. R – Certamente si, perché ci sono tutte le premesse biologiche, soprattutto grazie alla capacità dell’HA di stabilizzare il coagulo. Questo aspetto è stato dimostrato da molti anni in diversi settori della medicina rigenerativa su riviste ad alto “impact factor”. Purtroppo non è stato ancora dimostrato in odontoiatria con studi randomizzati altrettanto validi, ma sono in corso diversi lavori in merito sia con il mio gruppo alla Sapienza che in altri centri internazionali.
R – Certamente si, perché ci sono tutte le premesse biologiche, soprattutto grazie alla capacità dell’HA di stabilizzare il coagulo. Questo aspetto è stato dimostrato da molti anni in diversi settori della medicina rigenerativa su riviste ad alto “impact factor”. Purtroppo non è stato ancora dimostrato in odontoiatria con studi randomizzati altrettanto validi, ma sono in corso diversi lavori in merito sia con il mio gruppo alla Sapienza che in altri centri internazionali. D – Può essere impiegato anche in GBR?
D – Può essere impiegato anche in GBR? D – E’ preferibile l’impiego di HA cross–linked o non cross-linked?
D – E’ preferibile l’impiego di HA cross–linked o non cross-linked?